Binet F, Mawambo G, Sitaras N, Tetreault N, Lapalme E, Favret S, Cerani A, Leboeuf D, Tremblay S, Rezende F, Juan AM, Stahl A, Joyal JS, Milot E, Kaufman RJ, Guimond M, Kennedy TE, Sapieha P. Neuronal ER stress impedes myeloid-cell-induced vascular regeneration through IRE1α degradation of netrin-1. Cell Metab. 2013 Mar 5;17(3):353-71.
Impact Scientifique: Cette étude démontre que dans un être en santé, les neurones communiquent avec le système immunitaire pour réparer des blessures vasculaires. Cet article démontre, pour la première fois, que les cellules nerveuses de l’œil produisent une molécule (la nétrine) qui reprogramme certaines cellules immunitaires pour qu’elles promeuvent la régénération de vaisseaux sanguins fonctionnels. Ces mécanismes protecteurs sont défaillants dans certaines maladies neuro-vasculaires tel que la rétinopathie diabétique. Cette importante cause de cécité est caractérisée par une phase initiale de dégénération de vaisseaux et une seconde phase de croissance compensatoire, mais anarchique, des vaisseaux sanguins de l’œil. La séquence d’évènements cellulaires et moléculaires identifié dans cette étude pourrait possiblement être modulée afin de freiner la progression de la rétinopathie diabétique et ultimement régénérer les vaisseaux sanguins compromis.
Contribution du RRSV: Le RRSV a octroyé une bourse d’étude à l’auteur principal de l’article, ce qui a permis la réalisation du projet.
* * *
Résumé original
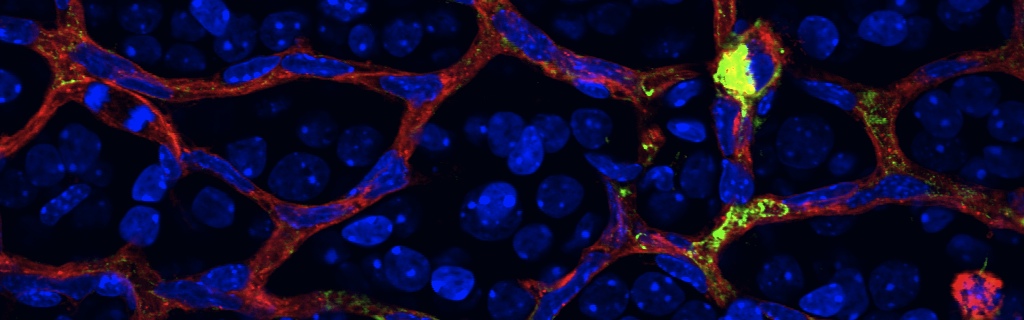
In stroke and proliferative retinopathy, despite hypoxia driven angiogenesis, delayed revascularization of ischemic tissue aggravates the loss of neuronal function. What hinders vascular regrowth in the ischemic central nervous system remains largely unknown. Using the ischemic retina as a model of neurovascular interaction in the CNS, we provide evidence that the failure of reparative angiogenesis is temporally and spatially associated with endoplasmic reticulum (ER) stress. The canonical ER stress pathways of protein kinase RNA-like ER kinase (PERK) and inositol-requiring enzyme-1α (IRE1α) are activated within hypoxic/ischemic retinal ganglion neurons, initiating a cascade that results in angiostatic signals. Our findings demonstrate that the endoribonuclease IRE1α degrades the classical guidance cue netrin-1. This neuron-derived cue triggers a critical reparative-angiogenic switch in neural macrophage/microglial cells. Degradation of netrin-1, by persistent neuronal ER stress, thereby hinders vascular regeneration. These data identify a neuronal-immune mechanism that directly regulates reparative angiogenesis.
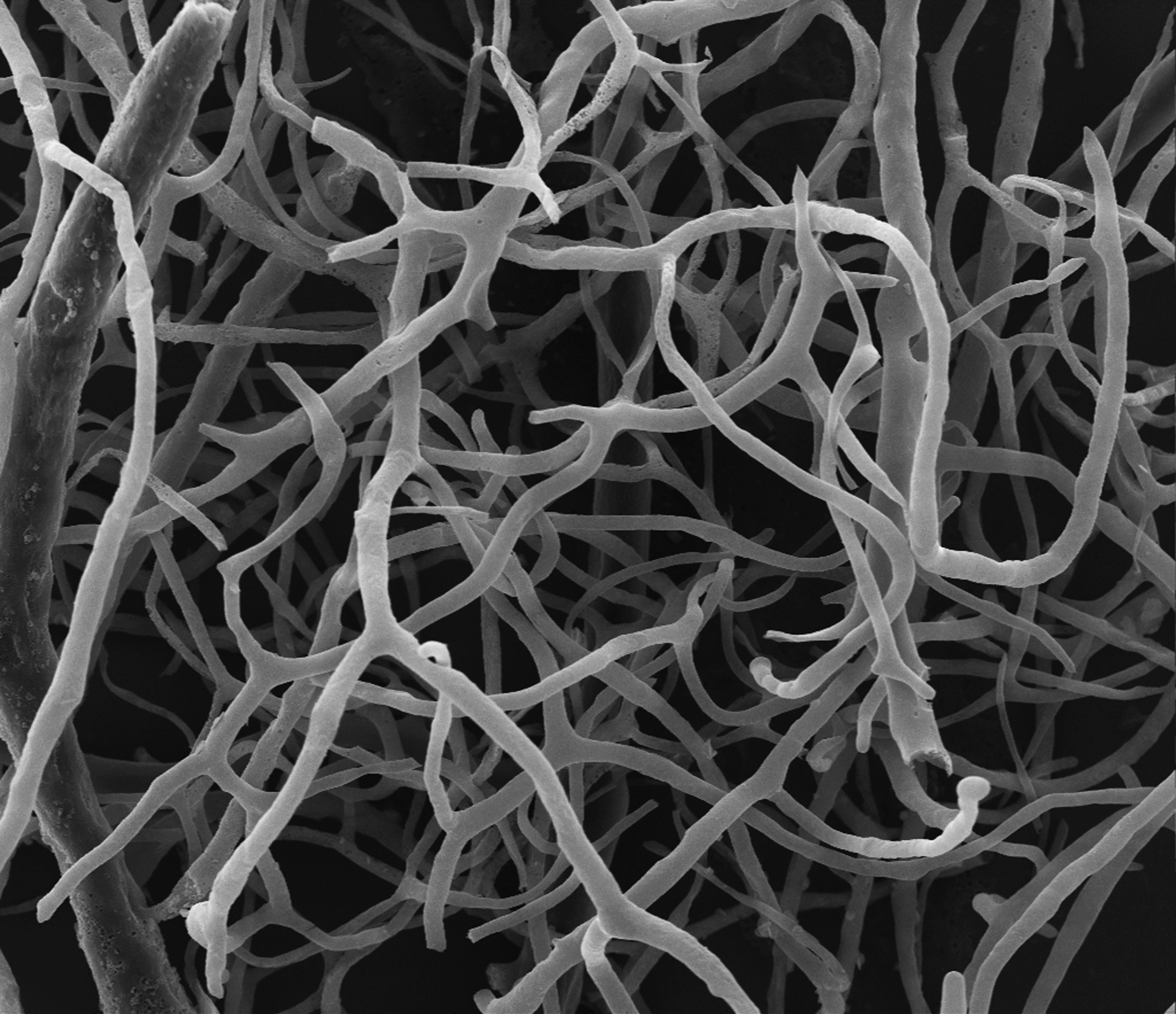
Image en microscopie électronique d’un réseau vasculaire rétinien de souris