Agustin Cerani, Nicolas Tetreault, Catherine Menard, Eric Lapalme, Chintan Patel, Nicholas Sitaras, Felix Beaudoin, Dominique Leboeuf, Vincent De Guire, François Binet, Agnieszka Dejda, Flavio A. Rezende, Khalil Miloudi, Przemyslaw Sapieha. Neuron-derived semaphorin 3A is an early inducer of vascular permeability in diabetic retinopathy via neuropilin-1. Cell Metab. 2013 Oct 1;18(4):505-18.
→ Télécharger l’article
Impact Scientifique: Cette étude a permis la découverte d’un nouveau mécanisme susceptible d’induire l’apparition d’un œdème maculaire chez les patients diabétiques. En mettant davantage l’accent sur les mécanismes précoces et non plus à moyen terme de la rétinopathie, cette voie pourrait être une toute nouvelle alternative expérimentale aux traitements existants. Les auteurs ont pu mettre en évidence chez des patients humains, puis dans un modèle animal, que la Semaphorin 3A produite par les neurones est fortement exprimée au cours du diabète. Initialement reconnue comme une molécule de « guidage » vasculaire et neuronale lors de la formation physiologique de l’œil, la Semaphorin 3A est à nouveau massivement produite chez les patients souffrant de rétinopathie diabétique. Sa rapidité d’expression en comparaison à d’autres molécules telles que le VEGF, produit plus tardivement, en fait une cible thérapeutique d’intérêt. Cette découverte est d’ailleurs intérêt clinique, puisque la neutralisation de la Semaphorin 3A a permis de réduire de façon significative la perméabilité vasculaire associée au diabète. Une nouvelle étape pourrait donc voir le jour dans l’évolution de la conception des traitements, afin de réduire le risque d’évolution des rétinopathies diabétiques.
Contribution du Réseau: Le RRSV a octroyé une bourse d’étude à l’auteur principal de l’article, ce qui a permis la réalisation du projet.
* * *
Résumé original
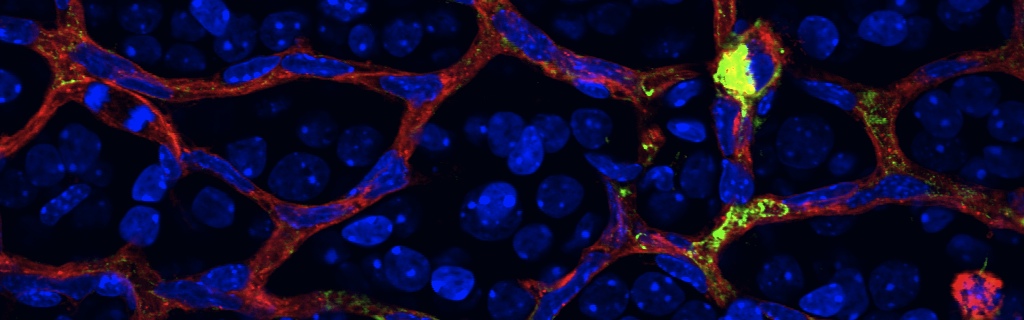
The deterioration of the inner blood-retinal barrier and consequent macular edema is a cardinal manifestation of diabetic retinopathy (DR) and the clinical feature most closely associated with loss of sight. We provide evidence from both human and animal studies for the critical role of the classical neuronal guidance cue, semaphorin 3A, in instigating pathological vascular permeability in diabetic retinas via its cognate receptor neuropilin-1. We reveal that semaphorin 3A is induced in early hyperglycemic phases of diabetes within the neuronal retina and precipitates initial breakdown of endothelial barrier function. We demonstrate, by a series of orthogonal approaches, that neutralization of semaphorin 3A efficiently prevents diabetes-induced retinal vascular leakage in a stage of the disease when vascular endothelial growth factor neutralization is inefficient. These observations were corroborated in Tg(Cre-Esr1)/Nrp1(flox/flox) conditional knockout mice. Our findings identify a therapeutic target for macular edema and provide further evidence for neurovascular crosstalk in the pathogenesis of DR.
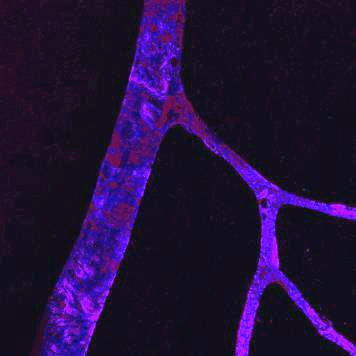
Vaisseaux rétiniens naissants avec interaction entre la microglie et les cellules d’extrémité.