Thèmes de recherche de l’axe Rétine et segment postérieur
Quatre grandes maladies de la rétine et du segment postérieur figurent à l’agenda de la programmation scientifique 2013-2017 du RRSV, soit la dégénérescence maculaire liée à l’âge (DMLA), la rétinopathie diabétique, le mélanome uvéal et le glaucome.
Dégénérescence maculaire liée à l’âge
Rétinopathie diabétique
La rétinopathie diabétique est la 3e cause de cécité dans les pays développés. Elle est caractérisée par des micro-anévrismes, une vaso-oblitération et un œdème de la rétine, souvent suivis d’une néovascularisation pré-rétinienne aberrante. Les traitements disponibles à l’heure actuelle ne visent que l’œdème et la néovascularisation, sans considération spécifique pour la vaso-oblitération et l’inflammation vasculaire. Alors que l’oxydation et l’inflammation sont intimement impliquées dans la pathogenèse de la rétinopathie diabétique, les anti-oxydants disponibles ne sont pas efficaces et seuls les anti-inflammatoires stéroïdiens ont réellement été étudiés jusqu’à ce jour. Les chercheurs de cet axe de recherche du Réseau s’intéressent à identifier des molécules représentant des cibles majeures dans cette pathologie. De plus, les cellules souches mésenchymateuses pourraient présenter un bénéfice significatif grâce à leurs propriétés anti-inflammatoires.
Mélanome uvéal
Le mélanome uvéal est la tumeur maligne intraoculaire la plus fréquente chez l’adulte. Ce cancer est fortement métastatique et démontre une résistance notoire aux traitements anticancéreux conventionnels. Plus de la moitié des patients décèdent de métastases, principalement hépatiques, malgré un traitement efficace de la tumeur oculaire. Les micrométastases, déjà présentes mais non détectées au moment du diagnostic de la tumeur primaire, constituent un obstacle majeur au succès du traitement systémique. Il est donc primordial de trouver une thérapie adjuvante pour cette néoplasie. Plusieurs avenues thérapeutiques sont envisagées par les chercheurs de cet axe de recherche du Réseau. Celles-ci incluent l’utilisation d’inhibiteurs spécifiques de récepteurs identifiés dans la signature moléculaire des tumeurs à haut risque de développer des métastases, l’exploration des mécanismes moléculaires d’adaptation à l’hypoxie et la caractérisation des interactions synergiques entre les cellules cancéreuses et les cellules stromales du microenvironnement tumoral.
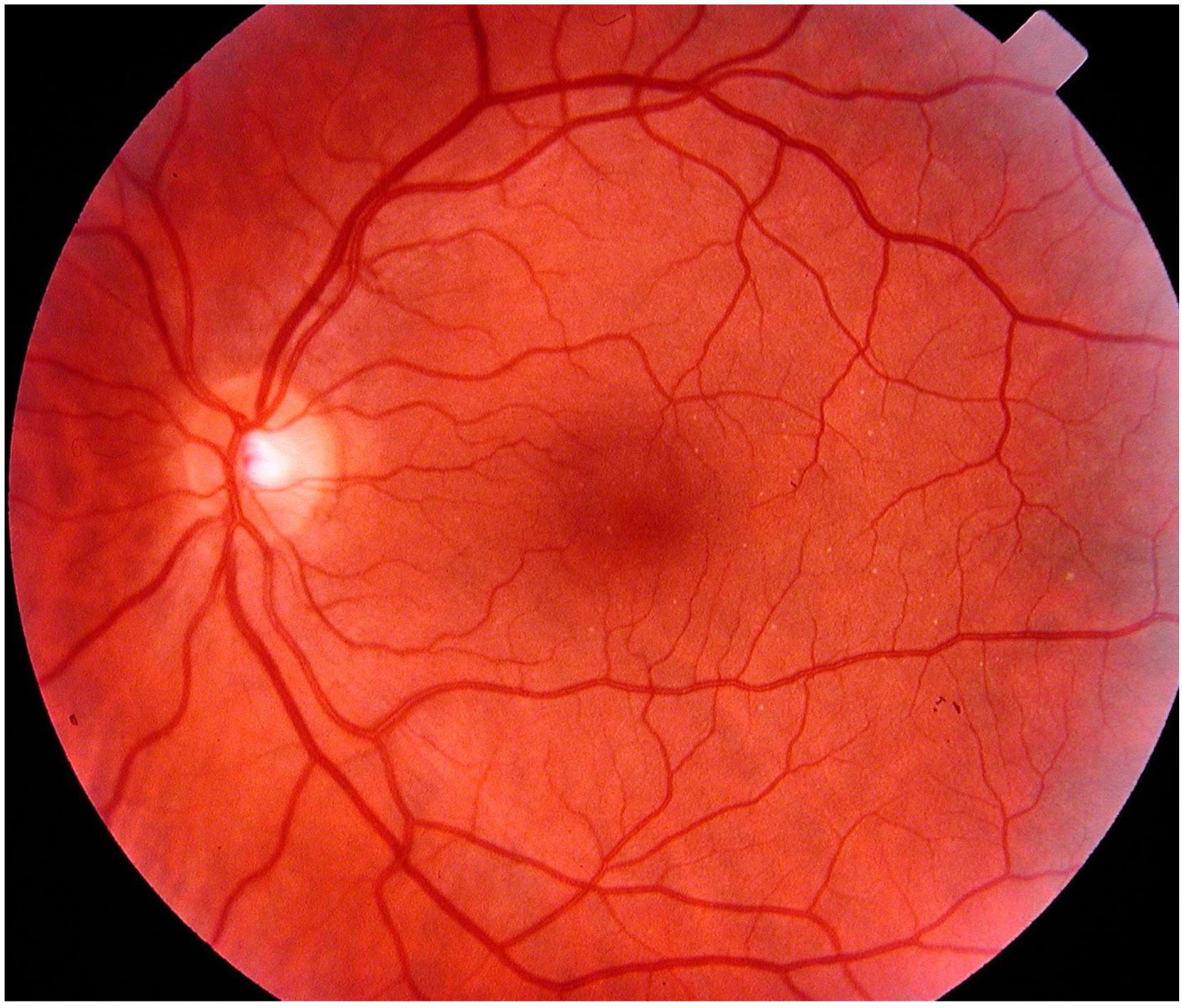
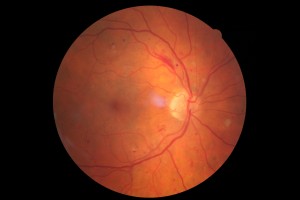
Fond d’œil normal. On distingue clairement la papille (rond blanc au centre à gauche) et les vaisseaux sanguins.
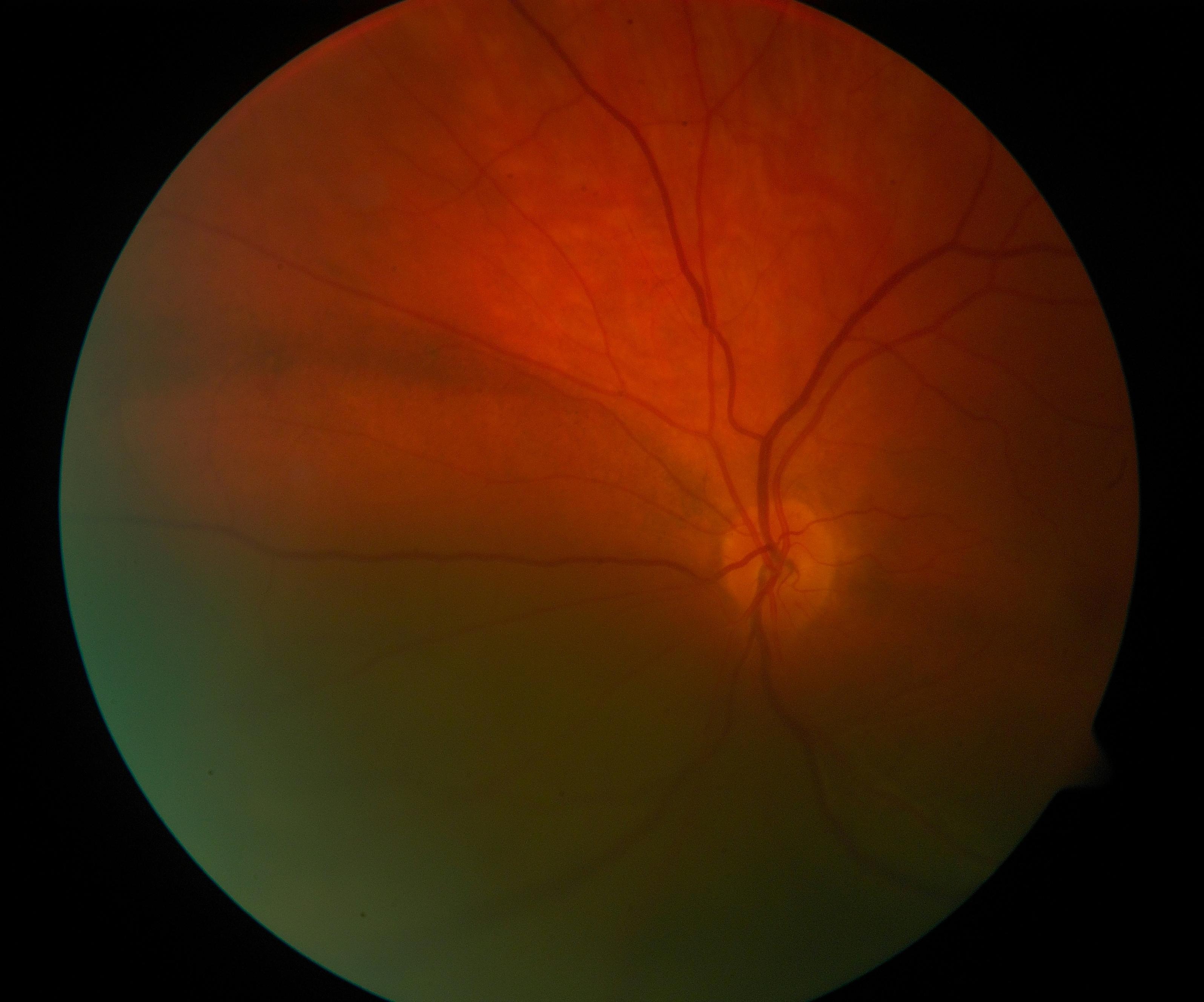
Fond d’œil d’un patient souffrant d’un mélanome uvéal. La région foncée correspond à celle où est localisé le mélanome.
Glaucome
Le glaucome cause une neurodégénérescence de la rétine et du nerf optique. Il s’agit de la principale cause de cécité irréversible mais évitable. Il a été estimé qu’en 2020, plus de 11 millions de personnes dans le monde seront aveugles à cause du glaucome. L’augmentation de la pression intraoculaire est reconnue comme étant le facteur de risque principal. Toutefois, le glaucome peut aussi être normotensif. Le mécanisme par lequel la pression cause la mort des cellules ganglionnaires rétiniennes et endommage le nerf optique est encore mal compris. Les seuls traitements disponibles à l’heure actuelle incluent l’utilisation d’hypotenseurs oculaires et la chirurgie. Les travaux de diverses équipes de cet axe de recherche du Réseau intègrent une approche multidisciplinaire axée sur la prévention, le diagnostic précoce et les traitements curatifs et palliatifs du glaucome. De nouveaux composés pharmacologiques ont été identifiés et leur efficacité a été démontrée chez l’animal. Toutefois, leur potentiel thérapeutique sur la perception visuelle corticale reste à démontrer. De plus, un nouveau mécanisme de dommage basé sur l’étirement des axones du nerf optique a été proposé ainsi qu’un nouveau mode d’imagerie non invasif.
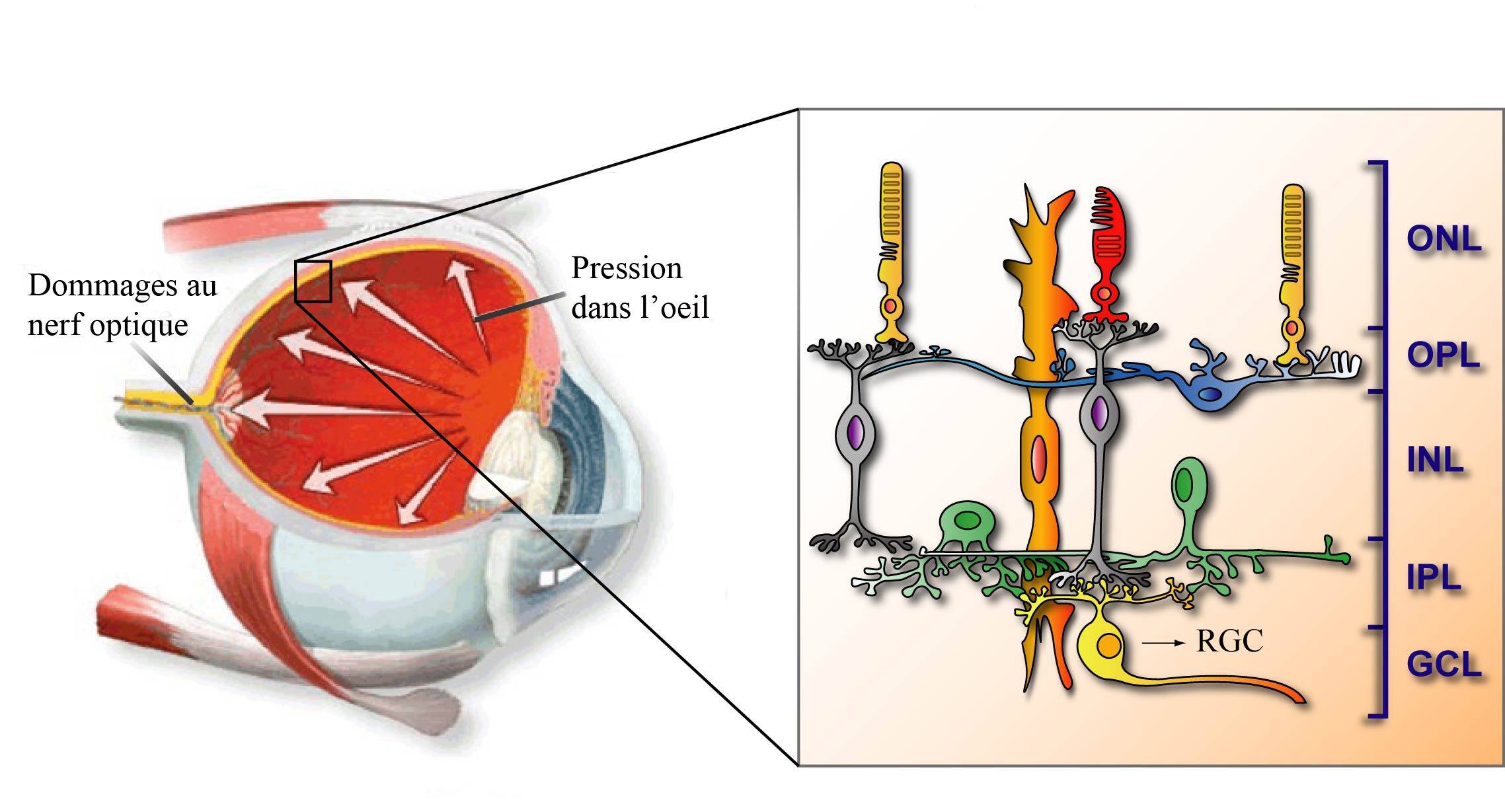
Au cours du glaucome, la pression augmente à l’intérieur de l’œil, ce qui mène à des dommages au niveau du nerf optique, i.e. à la mort des cellules ganglionnaires (RGC). Dans le schéma de droite, on peut voir les différentes cellules nerveuses et gliales de la rétine qui sont regroupées en différentes couches : ONL, couche nucléaire externe; OPL, couche plexiforme externe; INL, couche nucléaire interne; IPL, couche plexiforme interne; GCL, couche de cellules ganglionnaires. Cette image a été préparée par Frédéric Lebrun-Julien de l’équipe du Dr Adriana Di Polo.
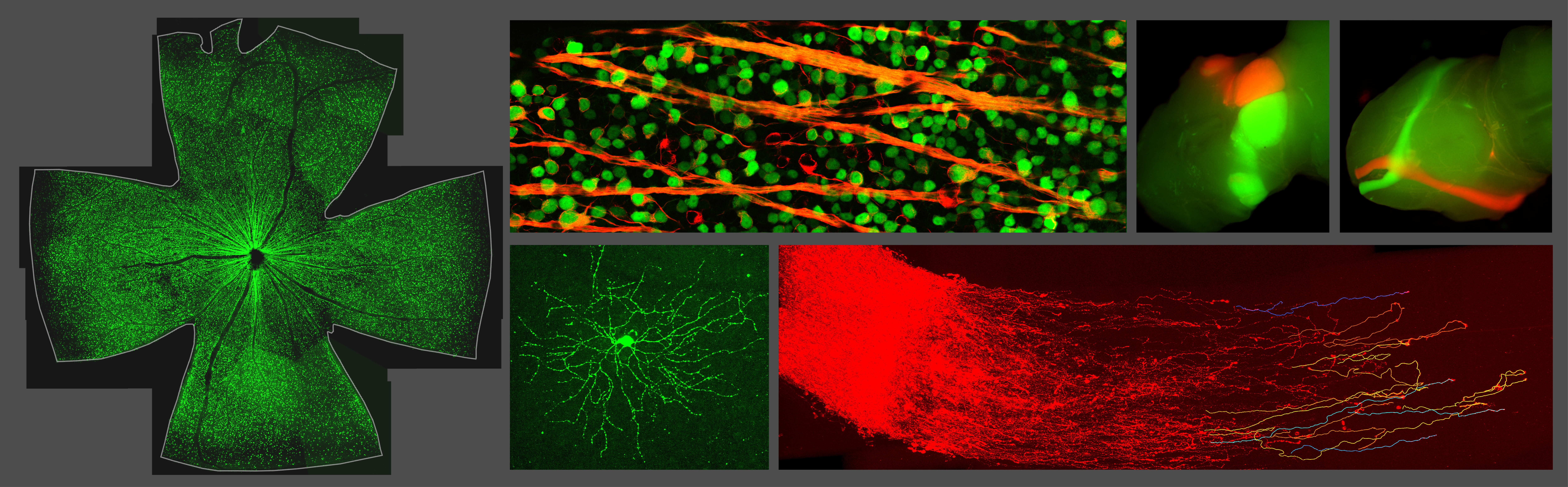
Modèle de dégénérescence et de régénération des cellules ganglionnaires de la rétine prenant place au cours du glaucome. De gauche à droite: Expression transgénique de la protéine fluorescente verte (GFP) dans les cellules ganglionnaires d’une rétine de souris adulte étalée. À plus fort grossissement, marquage immunohistochimique des cellules ganglionnaires de la rétine avec un anticorps dirigé contre la tubuline b 3 (rouge) et après expression transgénique de la GFP. Vue dorsale et ventrale des projections axonales des cellules ganglionnaires de l’œil gauche (rouge) et droit (vert) dans le cerveau. Arbre dendritique d’une cellule ganglionnaire isolée. Traçage fluorescent (rouge) des axones en régénération dans le nerf optique de souris adulte entier transparent, après blessure (à gauche). Cette image a été préparée par le Dr Vincent Pernet.