Joyal JS, Sitaras N, Binet F, Rivera JC, Stahl A, Zaniolo K, Shao Z, Polosa A, Zhu T, Hamel D, Djavari M, Kunik D, Honoré JC, Picard E, Zabeida A, Varma DR, Hickson G, Mancini J, Klagsbrun M, Costantino S, Beauséjour C, Lachapelle P, Smith LE, Chemtob S, Sapieha P. Ischemic neurons prevent vascular regeneration of neural tissue by secreting semaphorin 3A. Blood. 2011 Jun 2;117(22):6024-35.
Impact scientifique: Les rétinopathies prolifératives sont des maladies oculaires graves pouvant mener à la cécité. Ayant plusieurs origines (diabète, oxygène à la naissance), elles sont généralement considérées comme des désordres vasculaires causés par un changement dans l’oxygénation de la rétine. Toutefois, le développement de cette maladie n’est pas encore complètement élucidé. Cet article démontre que, lors d’une ischémie prolongée, les cellules ganglionnaires de la rétine produisent une molécule vaso-répulsive, la Semaphorine 3A, qui bloque la régénérescence vasculaire dans les régions les plus hypoxique de la rétine. Ces nouvelles connaissances permettent de comprendre un point clé de la maladie et font de la Sémaphorine 3A une cible thérapeutique de choix pour contrer cette cause majeure de cécité.
Contribution du Réseau: Ces travaux ont été exécutés en collaboration par plusieurs membres du RRSV et supportés en partie par le réseau (bourse aux étudiants Nicholas Sitaras et François Binet).
* * *
Résumé original
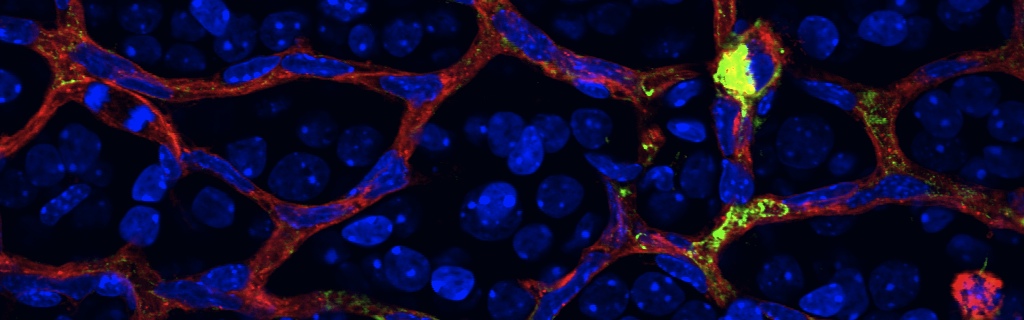
The failure of blood vessels to revascularize ischemic neural tissue represents a significant challenge for vascular biology. Examples include proliferative retinopathies (PRs) such as retinopathy of prematurity and proliferative diabetic retinopathy, which are the leading causes of blindness in children and working-age adults. PRs are characterized by initial microvascular degeneration, followed by a compensatory albeit pathologic hypervascularization mounted by the hypoxic retina attempting to reinstate metabolic equilibrium. Paradoxically, this secondary revascularization fails to grow into the most ischemic regions of the retina. Instead, the new vessels are misdirected toward the vitreous, suggesting that vasorepulsive forces operate in the avascular hypoxic retina. In the present study, we demonstrate that the neuronal guidance cue semaphorin 3A (Sema3A) is secreted by hypoxic neurons in the avascular retina in response to the proinflammatory cytokine IL-1β. Sema3A contributes to vascular decay and later forms a chemical barrier that repels neo-vessels toward the vitreous. Conversely, silencing Sema3A expression enhances normal vascular regeneration within the ischemic retina, thereby diminishing aberrant neovascularization and preserving neuroretinal function. Overcoming the chemical barrier (Sema3A) released by ischemic neurons accelerates the vascular regeneration of neural tissues, which restores metabolic supply and improves retinal function. Our findings may be applicable to other neurovascular ischemic conditions such as stroke.
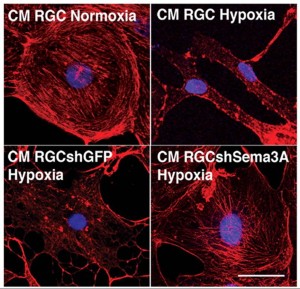
L’hypoxie détruit les réseaux d’actine des cellules endothéliales. Cette réaction est inhibée lorsqu’on empêche la production de Sémaphorine3a.