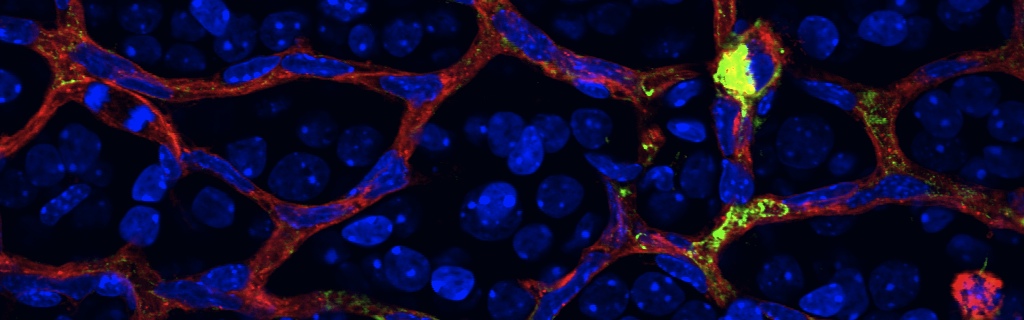
Joyal JS, Nim S, Zhu T, Sitaras N, Rivera JC, Shao Z, Sapieha P, Hamel D, Sanchez M, Zaniolo K, St-Louis M, Ouellette J, Montoya-Zavala M, Zabeida A, Picard E, Hardy P, Bhosle V, Varma DR, Gobeil F Jr, Beauséjour C, Boileau C, Klein W, Hollenberg M, Ribeiro-da-Silva A, Andelfinger G, Chemtob S. Subcellular localization of coagulation factor II receptor-like 1 in neurons governs angiogenesis. Nat Med. 2014 Oct;20(10):1165-73.
Impact scientifique: Il a été démontré que les récepteurs couplés aux protéines G (RCPG) fonctionnent traditionnellement via leur localisation à la surface membranaire des cellules. L’étude actuelle, publiée dans Nature Medicine, démontre, pour la première fois, un concept innovateur par lequel un RCPG (nommé précisément, ‘coagulation factor II receptor-like 1’) migre de la membrane plasmique jusqu’au noyau de neurones de la rétine pour réguler l’expression de gènes pro-angiogéniques (distincts de ceux activés par le récepteur à la surface), et ainsi gouverner l’angiogénèse rétinienne in vivo. Puisque plusieurs médicaments agissent sur les RCPG, sans égard à leur site d’action dans la cellule, nos résultats laissent présager que des médicaments formulés pour cibler ce récepteur nucléaire pourraient un jour permettre de prévenir la croissance anormale de vaisseaux sanguins rétiniens, tel que dans la rétinopathie diabétique et du prématuré.
Contribution du Réseau: Le RRSV a permis de consolider des collaborations entre des membres de même réseau (eg. Chemtob, Hardy, Sapieha) ainsi qu’avec des membres d’autres réseaux FRQS (eg. Gobeil, Beauséjour, Andelfinger), et de supporter la relève en formation (eg. Shao, Zaniolo, Picard, Hamel).
* * *
Résumé original
Neurons have an important role in retinal vascular development. Here we show that the G protein–coupled receptor (GPCR) coagulation factor II receptor-like 1 (F2rl1, previously known as Par2) is abundant in retinal ganglion cells and is associated with new blood vessel formation during retinal development and in ischemic retinopathy. After stimulation, F2rl1 in retinal ganglion cells translocates from the plasma membrane to the cell nucleus using a microtubule-dependent shuttle that requires sorting nexin 11 (Snx11). At the nucleus, F2rl1 facilitates recruitment of the transcription factor Sp1 to trigger Vegfa expression and, in turn, neovascularization. In contrast, classical plasma membrane activation of F2rl1 leads to the expression of distinct genes, including Ang1, that are involved in vessel maturation. Mutant versions of F2rl1 that prevent nuclear relocalization but not plasma membrane activation interfere with Vegfa but not Ang1 expression. Complementary angiogenic factors are therefore regulated by the subcellular localization of a receptor (F2rl1) that governs angiogenesis. These findings may have implications for the selectivity of drug actions based on the subcellular distribution of their targets.
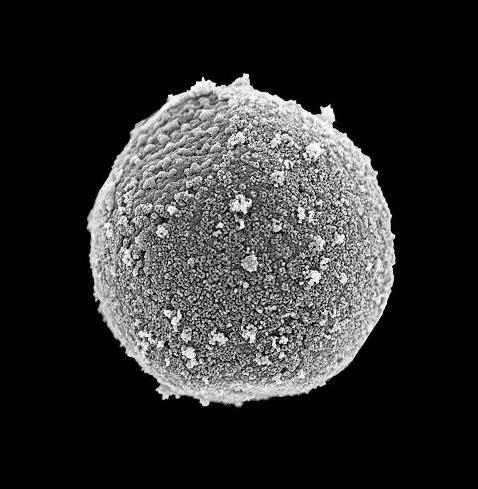
Pureté d’un noyau isolé confirmée par microscopie électronique à balayage